Галогенфосфины
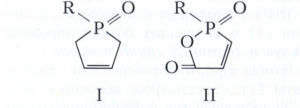 ГАЛОГЕНФОСФИНЫ, фосфорорганические соединения общей формулы RnPHal3-n (R - углеводородный радикал, n - 1, 2). Большинство галогенфосфинов - жидкости с неприятным запахом; растворимы в органических растворителях. Галогенфосфины реагируют с водой и другими соединениями, имеющими в молекуле подвижный атом водорода; легко окисляются на воздухе; CH3PF2 и (СН3)2PCl воспламеняются. Благодаря электроно-донорной способности галогенфосфины присоединяют серу, галогены, хлорамины (дифторфосфины - также HF, HCl, HOR, Н2NR) с образованием различных производных фосфора (V); с переходными металлами образуют комплексные соединения, например Ni(RPF2)4. В присутствии оснований галогенфосфины взаимодействуют с нуклеофильными реагентами с образованием замещённых производных типа RnPX3-n или RP(Hal)Х (Х-OR, NHR, NR2, SR). С альдегидами и кетонами галогенфосфины образуют α-галогеналкильные производные, например RP(О)Cl-CHClR, с иминами (в присутствии воды) - α-аминоалкильные производные, с диенами и ненасыщенными карбоновыми кислотами - циклические фосфиноксиды (формула I) и фосфинаты (II). При восстановлении галогенфосфинов в зависимости от условий образуются фосфины, циклополифосфины или дифосфины.
ГАЛОГЕНФОСФИНЫ, фосфорорганические соединения общей формулы RnPHal3-n (R - углеводородный радикал, n - 1, 2). Большинство галогенфосфинов - жидкости с неприятным запахом; растворимы в органических растворителях. Галогенфосфины реагируют с водой и другими соединениями, имеющими в молекуле подвижный атом водорода; легко окисляются на воздухе; CH3PF2 и (СН3)2PCl воспламеняются. Благодаря электроно-донорной способности галогенфосфины присоединяют серу, галогены, хлорамины (дифторфосфины - также HF, HCl, HOR, Н2NR) с образованием различных производных фосфора (V); с переходными металлами образуют комплексные соединения, например Ni(RPF2)4. В присутствии оснований галогенфосфины взаимодействуют с нуклеофильными реагентами с образованием замещённых производных типа RnPX3-n или RP(Hal)Х (Х-OR, NHR, NR2, SR). С альдегидами и кетонами галогенфосфины образуют α-галогеналкильные производные, например RP(О)Cl-CHClR, с иминами (в присутствии воды) - α-аминоалкильные производные, с диенами и ненасыщенными карбоновыми кислотами - циклические фосфиноксиды (формула I) и фосфинаты (II). При восстановлении галогенфосфинов в зависимости от условий образуются фосфины, циклополифосфины или дифосфины.
Реклама
В промышленности алкилдихлорфосфины (в основном СН3РCl2) получают парофазным фосфорилированием углеводородов тригалогенидами Р при температуре 300-700 °С (катализаторы - кислород, галогенпроизводные углеводородов, алюмосиликаты) или алкилированием тригалогенидов Р металлоорганическими соединениями; ароматические галогенфосфины получают фосфорилированием аренов тригалогенидами Р в присутствии AlCl3 или арилированием PHal3 солями арилдиазония. Используют галогенфосфины в производстве антипиренов, инсектицидов, лекарственных препаратов, экстрагентов, катализаторов, модификаторов полимеров и др.
Лит.: Weissermel К. а. о. Advances in organophosphorus chemistry based on dichloro(methyl) phosphane // Angewandte Chemie. International edition. 1981. Bd 20. № 3.
Г. И. Дрозд.