Карбкатионы
КАРБКАТИОНЫ (карбокатионы), органические катионы с чётным числом электронов, положительный заряд в которых сосредоточен на одном или делокализован на нескольких атомах углерода. Карбкатионы подразделяют на карбениевые ионы с трёхкоординированным атомом углерода общей формулы R3C+ (R - Н, алкильный или арильный радикал), например трет-бутильный катион (СН3)3С+, и карбониевые ионы с пятикоординированным атомом углерода, образующим три σ-связи и трёхцентровую двухэлектронную связь, R5C+, например 2-норборнильный катион (формула).
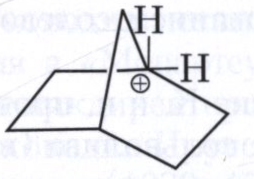
Карбениевые ионы образуются при гетеролитическом разрыве связи С-Х (Х - атом галогена, Н, N≡N+ и другие группировки, способные отщепляться вместе с парой электронов), а также в результате присоединения протона по кратной связи или удаления электрона от свободного радикала. Один из способов образования карбониевых ионов - протонирование циклоалканов или алканов в сверхкислых средах (например, смеси HOSO2F и SbF5) при низких температурах. Устойчивость карбкатионов растёт в полярных растворителях (из-за сольватации), а также по мере увеличения степени делокализации заряда. Эффективно делокализуют заряд ненасыщенные фрагменты (кратные связи, фенильные радикалы) и электронодонорные заместители (OR, NR2 и др.).
Реклама
Карбкатионы чрезвычайно реакционноспособны (легко изомеризуются в более устойчивые карбкатионы, взаимодействуют с нуклеофилами, отщепляют протон с образованием алкенов). Карбкатионы являются интермедиатами многих гетеролитических реакций (электрофильного замещения в ароматическом ряду, электрофильного присоединения, нуклеофильного замещения в алифатическом ряду, молекулярных перегруппировок, катионной полимеризации, каталитического крекинга и др.).
За развитие химии карбкатионов Дж. Ола был удостоен Нобелевской премии (1994).
Лит.: Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. 3-е изд. М., 2007. Ч. 2.
О. Б. Рудаков.