Азосоединения
АЗОСОЕДИНЕНИЯ, органические соединения общей формулы R—N=N—R’, где R и R’ - органические радикалы. Простейший представитель алифатических азосоединений - азометан CH3N=NCH3, ароматические азосоединения - азобензол С6Н5N=NC6Н5. Для азосоединений возможна цистранс-изомерия; при наличии в молекуле азосоединения сопряжённого с азогруппой электронодонорного заместителя (ОН, NH2 и др.) – азо-гидразонная таутомерия, например:
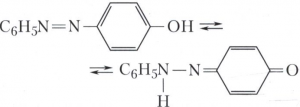
Азосоединения, обладающие азо-гидразонной таутомерией, используют в качестве кислотно-основных индикаторов, например метиловый оранжевый.
Ароматические азосоединения в основном термически стабильны; алифатические азосоединения при нагревании разлагаются с выделением азота и образованием свободных радикалов, благодаря чему применяются как инициаторы свободнорадикальной полимеризации (например, 2,2’-азо-бис-изобутиронитрил). При взаимодействии азосоединений со слабыми восстановителями (например, Na2S, соли Fe2+) образуются гидразосоединения (смотри Гидразина производные органические); более сильные восстановители (Zn, SnCl2, Na2S2О4 в щелочной среде, Н2 в присутствии катализатора) расщепляют азогруппу, например: C6H5N=NCH3→C6H5NH2 + CH3NH2. Мягкие окислители (водорода пероксид) окисляют ароматические азосоединения до азоксисоединений, сильные окислители (HNО3, С12) расщепляют азогруппу.
Алифатические азосоединения получают в основном окислением гидразосоединений, ароматические - реакцией азосочетания. Азосоединения получают также восстановлением нитро- и азоксисоединений, конденсацией первичных аминов с нитрозосоединениями. Ароматические азосоединения широко используют в качестве азокрасителей.
Литературу смотри при статье Азокрасители.