Джоуля-Томсона эффект
ДЖОУЛЯ-ТОМСОНА ЭФФЕКТ, изменение температуры реального газа при стационарном адиабатическом протекании его через пористую перегородку. При этом давление газа слева и справа от перегородки сохраняется постоянным. Явление открыто и исследовано в 1852-62 Дж. П. Джоулем и У. Томсоном в ходе экспериментов, предпринятых с целью изучения зависимости внутренней энергии реального газа от его объёма. Объём газа, протекающего через пористую перегородку, изменяется от значения V1 до значения V2(V2>V1), при этом совершается работа р2V2-р1V1, где р1 и р2 - значения давления до и после прохождения газа через перегородку; причём р1 > р2.Т.к. газ не получает теплоты (вследствие условия адиабатичности), то, согласно первому закону термодинамики, газ совершает работу за счёт изменения внутренней энергии U. Поэтому при протекании газа в условиях тепловой изоляции сохраняется постоянной величина Н = U + pV, называемая энтальпией. Из условия постоянства энтальпии следует, что изменение температуры Т на единицу давления (так называемый дифференциальный Джоуля-Томсона эффект) равно
Реклама
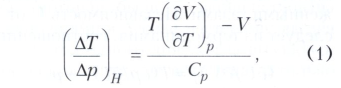
где Ср - теплоёмкость при постоянном давлении. Для 1 моля идеального газа V= RT/р (R - универсальная газовая постоянная), следовательно, Т(∂V/∂T)р=V, то есть для идеального газа Джоуля-Томсона эффект не имеет места.
Для реальных газов температурное приращение может быть как положительным, так и отрицательным. Если в качестве уравнения состояния использовать Ван дер Ваальса уравнение, то в приближении разреженного газа выражение (1) примет вид:
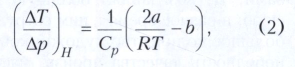
где а и b - постоянные, входящие в уравнение Ван дер Ваальса. Из формулы (2) видно, что значение величины ΔТ/Δр определяется соотношением между постоянными а и b, то есть конкуренцией сил отталкивания и притяжения. Джоуля-Томсона эффект будет иметь положительный знак при 2а/RT>b и отрицательный - при 2а/RT<b. Температура
![]()
которой соответствует нулевой эффект (нулевое приращение температуры), называется температурой инверсии (т.е. температурой, при которой эффект меняет знак). Формула (3) даёт возможность сопоставить температуру инверсии с критической температурой Ткр: т.к. а/b = (27/8)RTкp, то Ti = 6,75Ткр. Хотя это выражение может служить лишь приближённой оценкой для определения Тi опыт подтверждает, что чем ниже критическая температура, тем ниже температура инверсии. Например, для кислорода Ткр= 154,6 К, Ti = 893 К; для водорода Ткр = 33 К, Ti = 204,6 К.
В случае плотных газов Ti является функцией состояния, т. е. зависит от давления и плотности газа, и геометрическое место точек инверсии образует кривую инверсии.
В отличие от дифференциального Джоуля-Томсона эффекта (название «дифференциальный» отражает малость величин ΔТ и Δр), при так называемом интегральном Джоуля-Томсона эффекте перепады давления достигают значительных величин - десятков и сотен атмосфер. В технике интегральной Джоуля-Томсона эффект широко используется для получения низких температур и сжижения газов.
Лит.: Сивухин Д. В. Общий курс физики. 2-е изд. М., 1979. Т. 2: Термодинамика и молекулярная физика.
Л. А. Благонравов.