Абсорбция (Газов)
АБСОРБЦИЯ газов (латинский absorptio, от absorbeo - поглощать), объёмное поглощение газов и паров жидкостью или твёрдым телом (абсорбентами) с образованием раствора; частный случай сорбции. Процесс, обратный абсорбции, - десорбция. Абсорбция газов твёрдыми или расплавленными металлами с образованием твёрдых растворов или химических соединений называется окклюзией. Различают физическую абсорбцию, когда абсорбент является инертной средой по отношению к газу, и химическую абсорбцию, когда поглощаемый компонент химически взаимодействует с абсорбентом (смотри Хемосорбция).
Статика абсорбции характеризует термодинамическое равновесие раствора с парогазовой смесью, а также материальный и энергетический балансы процесса. Количество абсорбированного газа зависит не только от природы газа и жидкости, но также от давления, температуры системы и состава газовой фазы. В состоянии равновесия концентрация поглощаемого вещества в газовой фазе у* связана с равновесной абсорбцией - концентрацией поглощаемого вещества в жидкой фазе х*, равной растворимости данного газа в абсорбенте, соотношением: у* = mх*, где m - константа фазового равновесия (коэффициент распределения).
Реклама
При физической абсорбции с образованием идеального раствора газа в абсорбенте, когда силы взаимодействия между всеми молекулами в растворе одинаковы, растворимость газа определяется законом Рауля, если газ способен конденсироваться при температуре раствора, или законом Генри - для газов, критическая температура которых выше температуры раствора. Величину m вычисляют исходя из термодинамических свойств газа и жидкости или (чаще) определяют экспериментально. Поглотительная способность абсорбента - абсорбционная ёмкость, соответствующая предельному количеству газа, который поглощается единицей объёма абсорбента, и тепловой эффект процесса при химической абсорбции больше, чем при физической. При химической абсорбции растворимость сильно зависит от температуры. Влияние давления на ёмкость абсорбента обычно мало, поэтому химическая абсорбция термодинамически более выгодна, особенно для извлечения из газовой смеси примеси при небольшой её концентрации.
Данные по равновесию газ - жидкость используют при определении константы фазового равновесия m, а также при расчёте движущей силы процесса, равной (хгр* - х) или (у - угр*), где х, у - мольные доли жидкости и газа в объёме соответствующей фазы, хгр*, угр* - мольные доли жидкости и газа на межфазной поверхности. Отношение констант фазового равновесия для двух сравниваемых газов характеризует селективность абсорбента. Зависимость у* от х* при расчёте аппаратуры обычно называют равновесной линией.
Кинетика абсорбции. При абсорбции поглощаемый газ в результате молекулярной, конвективной, а также турбулентной диффузии из ядра газового потока переносится к границе раздела фаз и по такому же механизму распределяется по объёму жидкости. Скорость переноса характеризуется массовым потоком j, то есть числом молей вещества, переносимых за единицу времени через единицу площади межфазной поверхности по нормали к ней; j = βx(xгр*- х) = βу(у-yгр*)=Кy(y-y*) где βх, βу - коэффициенты массоотдачи для жидкой и газовой фаз, Ку - коэффициент массопередачи, отнесённый к газовой фазе, у* — мольная доля поглощаемого компонента в газе, которая отвечает равновесию с жидкостью состава х. Из уравнения (l/Ky) = = (l/βу) + (m/βх) определяют m как тангенс угла наклона равновесной линии. При химической абсорбции скорость растворения газа в жидкости, как правило, выше, чем при физической. Этот эффект может быть выражен через увеличение движущей силы абсорбции или (чаще) коэффициент массоотдачи. Во втором случае используют так называемый коэффициент ускорения х = β’х/βх, где β’х - коэффициент массоотдачи в жидкой фазе при химической абсорбции. Коэффициент массоотдачи определяет скорость абсорбции и позволяет рассчитать необходимую для заданной степени разделения (или очистки) газа высоту слоя насадки. Другой подход к расчёту кинетики процесса основан на предположении о достижении равновесия между жидкостью и газом в зоне контакта с последующим введением поправки, учитывающей эффективность ступени контакта (степень приближения к равновесию), равной отношению реализованного изменения состава к изменению, которое произошло бы при достижении равновесия.
При циклических процессах физической абсорбции в основном потребляется электроэнергия на перекачивание раствора, а при химической абсорбции - теплота на его регенерацию. Энергетические затраты на регенерацию абсорбента обычно превышают расход энергии на абсорбцию.
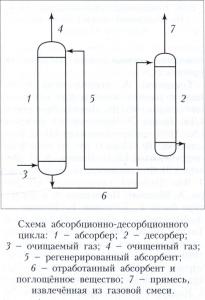 Основы технологии абсорбционных процессов. В промышленности процесс абсорбции осуществляют обычно в вертикальных колонных аппаратах - абсорберах, имеющих развитую поверхность соприкосновения газа и жидкости. Наиболее распространены насадочные аппараты (устаревший - скрубберы), заполненные слоями твёрдых тел различных размеров и формы - насадками для создания развитой поверхности контакта фаз, и тарельчатые аппараты, снабжённые расположенными одна над другой поперечными перегородками различной конструкции, или тарелками, с помощью которых по высоте колонны осуществляется многократный дискретный контакт газа (пара) с жидкостью. Процесс часто осуществляют по абсорбционно-десорбционному циклу (смотри рисунок), однако стадия десорбции может отсутствовать, если в результате абсорбции получают готовый продукт или регенерация поглотителя нецелесообразна (невозможна). Регенерацию абсорбента (десорбцию газов) можно проводить снижением давления, нагреванием, отдувкой плохо растворимыми газами и парами кипящего абсорбента.
Основы технологии абсорбционных процессов. В промышленности процесс абсорбции осуществляют обычно в вертикальных колонных аппаратах - абсорберах, имеющих развитую поверхность соприкосновения газа и жидкости. Наиболее распространены насадочные аппараты (устаревший - скрубберы), заполненные слоями твёрдых тел различных размеров и формы - насадками для создания развитой поверхности контакта фаз, и тарельчатые аппараты, снабжённые расположенными одна над другой поперечными перегородками различной конструкции, или тарелками, с помощью которых по высоте колонны осуществляется многократный дискретный контакт газа (пара) с жидкостью. Процесс часто осуществляют по абсорбционно-десорбционному циклу (смотри рисунок), однако стадия десорбции может отсутствовать, если в результате абсорбции получают готовый продукт или регенерация поглотителя нецелесообразна (невозможна). Регенерацию абсорбента (десорбцию газов) можно проводить снижением давления, нагреванием, отдувкой плохо растворимыми газами и парами кипящего абсорбента.
Физическая абсорбция, как правило, наиболее эффективна при грубой очистке от больших количеств газа под давлением. Химическую абсорбцию чаще всего применяют при извлечении малых количеств примесей и при тонкой очистке; при этом обычно существенно выше селективность абсорбента, ниже количество циркулирующего раствора вследствие большой поглотительной способности.
Абсорбция в природе и технологии. Абсорбция широко распространена в природе: процессы абсорбции определяют содержание кислорода в реках и озёрах, поверхностных слоях морей и океанов, регулируют физиологические процессы в живых организмах и прочее. Наиболее распространённые области практического применения процессов абсорбции: многотоннажные производства серной, соляной и азотной кислот, нитратов и других солей; выделение ценных компонентов из газовых смесей - бензина из коксового газа, ацетилена из газов крекинга или пиролиза природного горючего газа, бутадиена из контактного газа после разложения этилового спирта и прочее; очистка газа от примесей вредных компонентов - нефтяных и коксовых газов от Н2S, азотоводородной смеси для синтеза аммиака от СО2 и СО, санитарная очистка газов, выпускаемых в атмосферу, - топочных газов ТЭЦ от SO2, абгаза от Сl2, рекуперация летучих растворителей и др.
Лит.: Danckwerts Р. V. Gas-liquid reactions. N. Y., 1970; Рамм В. М. Абсорбция газов. 2-е изд. М., 1976; Astarita С., Savage D. W., Basio А. Gas treating with chemical solvents. N. Y., 1983; Seader J. D., Henley Е.J. Separation process principles. N. Y., 1998.
Н.Н. Кулов.