Амины
АМИНЫ, органические соединения, которые можно рассматривать как продукты замещения атомов водорода в молекуле аммиака на органические радикалы R. В зависимости от числа заместителей амины подразделяют на первичные RNH2, вторичные RR’NH, третичные RR’R"N. По числу аминогрупп в молекуле различают моно-, ди-, три- и полиамины. Известны также циклические амины, например пиперидин, хинуклидин.
Низшие амины - газы с аммиачным запахом, высшие - жидкости или твёрдые вещества. Алифатические амины более сильные основания, чем аммиак; ароматические - менее сильные. С минеральными кислотами амины образуют соли, например: RNH2 + HCl→ (RNH3]+Cl-, обычно растворимые в воде. Амины обладают нуклеофильными свойствами, в частности при взаимодействии первичных аминов с алкилгалогенидами образуются смеси вторичных, третичных аминов, а также четвертичные соли аммония, например [R4N]+Сl-. Первичные и вторичные амины ацилируются карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами с образованием N-замещённых амидов, например: RNH2 + CH3COOH →RNHCOCH3 + Н2О. Поликонденсация диаминов с дикарбоновыми кислотами, их эфирами или хлорангидридами приводит к полиамидам. Под действием азотистой кислоты HNО2 первичные алифатические амины превращаются в спирты: RNH2 + HNО2→RОН + N2 + Н2О; вторичные алифатические и ароматические амины - в N-нитрозоамины R2NNO; третичные алифатические амины обратимо реагируют с HNО2, образуя соли амина и N-нитрозоамин; первичные ароматические амины с HNО2 образуют соли диазония (смотри Диазотирование). Амины окисляются пероксидом водорода или органическими надкислотами, при этом из третичных аминов получаются N-оксиды амины, из вторичных - N,N-диалкилгидроксиламины, из первичных - N-нитрозопроизводные. Ароматические амины вступают в реакции электрофильного замещения, аминогруппа является орто- и параориентантом, в сильно кислых средах вследствие протонирования атома азота - мета - ориеитантом.
Реклама
Амины получают взаимодействием спиртов с аммиаком (аммонолиз спиртов) в присутствии катализаторов дегидратации, при этом образуются смеси первичных, вторичных и третичных аминов:
![]()
Этот метод применяется для производства низших алифатических аминов, прежде всего, метил- и этиламинов. Амины получают также восстановительным аминированием алифатических и циклоалифатических спиртов в присутствии водорода на катализаторах:
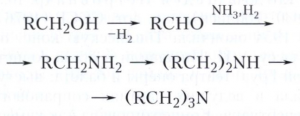
Для получения аминов используют: взаимодействие амидов алифатической и ароматической карбоновых кислот с щелочными растворами хлора, брома, йода (смотри Гофмана реакции); восстановление нитросоединений, главным образом для получения первичных ароматических аминов: С6Н5NО2+3Н2 →С6Н5NH2 + 2Н2О, в качестве восстановителей используется водород в присутствии Ni, Pt или Pd, реже - металлы Fe и Zn или сульфиды щелочных металлов (смотри Зинина реакция). Для обнаружения аминов используют ряд специфических реакций, например при нагревании с хлороформом в присутствии щёлочи первичные амины превращаются в изонитрилы, обладающие сильным неприятным запахом.
Амины - промежуточные продукты в производстве красителей, пестицидов, лекарств, полимеров (в том числе полиамидов и полиуретанов), ингибиторов коррозии, ПАВ, флотореагентов, абсорбентов, ускорителей вулканизации, антиоксидантов и др. Амины широко распространены в природе (алкалоиды, аминокислоты, некоторые витамины, гормоны и пр.). Многие амины обладают высокой физиологической активностью. Смотри также Анилин, Метиламины, Толуидины, Этилендиамин.
Лит.: McMurry J. Organic chemistry. 5th ed. Pacific Grove, 2000; Organic chemistry. Oxf.; N. Y., 2001.
Е. Д. Матвеева.