Гомогенная система
Смотрите также:
ГОМОГЕННАЯ СИСТЕМА (от гомо... и ...ген), термодинамическая система, все характеристики которой (например, химический состав, плотность, давление) постоянны или изменяются в пространстве непрерывно. Гомогенными могут быть газовые смеси, жидкие или твёрдые растворы и другие системы. Различают пространственно однородные и неоднородные гомогенные системы. У однородных гомогенных систем свойства в различных частях системы одинаковы, у неоднородных - различны. Примеры пространственно неоднородных гомогенных систем: газы, жидкости, газовые смеси, растворы во внешнем поле при условии, что при отсутствии поля они пространственно однородны. Однако благодаря непрерывному изменению свойств в неоднородной гомогенной системе, в отличие от гетерогенной системы, нет частей, ограниченных поверхностями раздела, на которых хотя бы одно свойство изменялось скачком. Гомогенная система однофазна, но может быть многокомпонентной.
ГОМОГЕННЫЙ КАТАЛИЗ, увеличение скорости химических реакций, протекающих в газовой или жидкой фазе, в результате действия катализаторов, находящихся в одной фазе с реагентами. Гетерофазная реакция СО + Н2О →← СО2 + Н2 также может быть гомогенной каталитической реакцией, поскольку проходит в объёме раствора катализатора (например, Rhl3) с растворённым СО.
Реклама
Историческая справка. Впервые явление гомогенного газофазного катализа обнаружили в 1806 году французские химики Н. Клеман и Ш. Дезорм, установившие влияние оксидов азота на скорость окисления SO2 при производстве серной кислоты камерным (нитрозным) методом. Сознательное применение гомогенного катализа начинается с работы К. С. Кирхгофа по кислотному гидролизу крахмала до глюкозы (1811). Одним из первых шагов в развитии гомогенного металлокомплексного катализа можно считать открытие М. Г. Кучеровым в 1881 году катализа солями ртути гидратации ацетилена. В 20 веке были открыты полимеризация ацетилена комплексами Cu(I) (американский химик Ю. Ньюленд, российский химик А. Л. Клебанский), гидроформилирование алкенов комплексами Со (немецкий химик О. Рёлен), циклополимеризация ацетилена и карбонилирование ацетилена, алкенов и спиртов комплексами Ni(0) и Ni(II) (немецкий химик В. Реппе), стереоспецифическая каталитическая полимеризация алкенов и диенов (К. Циглер, Дж. Натта - Нобелевская премия, 1963), катализ комплексами Pd(II) окисления алкенов до альдегидов и кетонов (в Германии - Ю. Смидт с сотрудниками, в России - И. И. Моисеев, М. Н. Варгафтик, Я. К. Сыркин), асимметрический катализ гидрирования и эпоксидирования с применением хиральных комплексов Rh, Ru и Ti (У. Ноулз, Р. Нойори, Б. Шарплесс - Нобелевская премия, 2001), процессы метатезиса алкенов и метатезисной полимеризации циклоалкенов (И. Шовен, Р. Шрок, Р. Граббс - Нобелевская премия, 2005). Катализаторы на основе апротонных органических сверхкислот были разработаны М. Е. Вольпиным с сотрудниками. Открытие процессов с участием комплексов металлов привело к созданию новой области каталитической химии и промышленного катализа - гомогенного металлокомплексного катализа. Важную роль в понимании сущности этого вида катализа как явления, связанного с превращениями молекул в координационной сфере металлокомплекса, сыграли работы И. И. Моисеева по изучению механизма реакций окисления алкенов в растворах комплексов Pd(II), Г. Стернберга, И. Уэндера, М. Орчина, Д. Бреслоу и Р. Хека (США) по исследованию механизма гидроформилирования алкенов в растворах комплексов Со(0), работы Дж. Хальперна (США) по изучению механизма активации Н2 комплексами металлов в реакциях восстановления неорганических окислителей и гидрирования алкенов.
Характеристики гомогенно-каталитических процессов. Основными характеристиками гомогенного каталитического процесса являются величины активности катализатора и селективности катализируемой реакции. Селективность может быть представлена через долю прореагировавшего исходного реагента, превращённого в целевой продукт с учётом стехиометрии реакции. Для выражения каталитической активности используют отношение начальной или стационарной скорости реакции к молярной концентрации активной формы катализатора - так называемую скорость (или частоту) оборотов катализатора (обозначается TOF, от английского turn-over frequency). На практике часто применяют связанную с TOF, но не идентичную ей величину - отношение суммарного мольного количества продукта реакции к суммарному мольному количеству катализатора и ко времени реакции, которую также называют TOF. Наглядной характеристикой активности и стабильности работы катализатора является число оборотов катализатора (TON, turn-over number), равное числу каталитических циклов в пересчёте на 1 моль катализатора (выражается отношением мольного количества продуктов реакции к мольному количеству катализатора).
Классификация гомогенно-каталитических процессов и их механизмы. Исходя из природы катализатора, т. е. специфических возможностей для взаимодействия с субстратом, гомогенные каталитические процессы подразделяют на следующие виды: кислотно-основной катализ протонными кислотами или основаниями Брёнстеда, электрофильный (с участием апротонных кислот Льюиса) и нуклеофильный (с участием оснований Льюиса) катализ, металлокомплексный катализ комплексными соединениями металлов, катализ органическими синтетическими соединениями, а также ферментативный катализ.
Кислотный катализ - активация субстратов, имеющих свободные электронные пары, протонными кислотами (смотри Кислоты и основания) - происходит в результате присоединения протона кислоты НА к субстрату. Протонирование субстрата в водных растворах кислот является обычно реакцией замещения воды в гидратированном катионе Н(Н2О)+n молекулой субстрата. Промежуточными активными частицами в кислотном катализе часто служат ионы карбения R+, которые так же, как и протон, сольватированы молекулами Н2О, органических растворителей или сильных кислот, например R(H2O)+, (С2Н5)3O+, RH2SO+4. Основный катализ - активация основаниями Брёнстеда - происходит в результате отщепления протона основанием от субстрата с образованием из молекулы субстрата анионной частицы, являющейся очень сильным нуклеофилом. Таким образом, гидратацию алкенов в присутствии сильных минеральных кислот - типичную кислотно-каталитическую реакцию - можно представить в виде последовательности стадий:
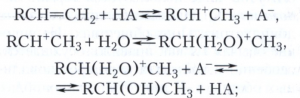
альдольную конденсацию ацетона в присутствии щелочей - пример основного катализа - в виде:
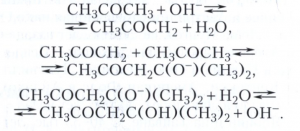
Очень сильные протонные кислоты (сверхкислоты) способны протежировать соединения, не имеющие свободных электронных пар, например алканы, с образованием ионов карбония RH+2 (CH+5 и др.). Ионы карбония участвуют в реакциях алкилирования, крекинга и изомеризации алканов.
Электрофильный катализ - активация электрофильными апротонными кислотами Льюиса - сопровождается понижением электронной плотности на реакционном центре субстрата (основания Льюиса) вплоть до образования иона карбения. По такому механизму происходит, в частности, алкилирование ароматических соединений; например, алкилирование бензола алкилбромидом по схеме C6H6 + RBr → C6H5R + НВr включает образование реакционноспособного комплекса R+[Al2Br7]- в результате взаимодействия катализатора Аl2Br6 с алкилбромидом и действие катиона карбения R+ на молекулу бензола.
В реакциях галогенсодержащих молекул (CBr4, RCOCl, SO2Cl2 и др.) с Аl2Вr6 или Аl2Сl6 возникают суперэлектрофильные частицы (например, СВr+3Аl2Вr-7 ). Суперэлектрофилы катализируют крекинг алканов в мягких условиях.
Протонные и апротонные (электрофильные) катализаторы ускоряют процессы алкилирования, ацилирования, диеновый синтез и даже некоторые окислительно-восстановительные реакции. Например, протонные кислоты катализируют окисление изопропанола трифенилкарбинолом до ацетона через стадию образования трифенилметильного катиона (С6Н5)3С+, апротонные кислоты (алкоголяты алюминия) - восстановление кетонов спиртами (Меервейна - Понндорфа - Верлея реакция)и диспропорционирование альдегидов (Тищенко реакция) через стадию образования комплекса между алкоголятом Al и карбонильным соединением.
Нуклеофильный катализ основаниями Льюиса происходит с образованием промежуточного продукта присоединения катализатора-нуклеофила к субстрату (например, при электрофильном бромировании алкенов в присутствии галогенид-ионов) или с образованием промежуточного продукта замещения (примером замещения у насыщенного атома С является гидролиз алкилгалогенидов в присутствии аниона I- - активного нуклеофильного катализатора и затем легко замещаемой группы).
При катализе органическими соединениями функции катализаторов, как правило, более сложны, чем электрофилов или нуклеофилов. Примеры этого вида гомогенного катализа - автокатализ гликолевым альдегидом конденсации формальдегида до сахаров в основных средах (реакция Бутлерова), разложение пероксидных радикалов, катализируемое n-бензохиноном по схеме
RR’C(OH)OO? + n-С6Н4O2→ RR’C=O + n-С6Н4О2Н? + О2,
RR’C(OH)OO· + n-С6Н4O2Н· → RR’C(OH)OOH + n-С6Н4O2,
катализ аминокислотой (пролином) альдольной конденсации, Манниха реакции и других процессов.
В большинстве процессов катализ комплексами металлов реализуется через промежуточные металлокомплексные интермедиаты, в том числе и в типичных окислительно-восстановительных процессах с участием неорганических реагентов. Например, при катализе комплексами Мо(III) восстановления молекулярного азота амальгамой натрия по схеме N2 + 4Na + 4Н2O → NH2NH2 + 4NaOH образующийся в результате взаимодействия N2 с Мо(III) комплекс [Мо4+—N=N—Мо4+] при действии Na превращается в анион [Mo4+=N—N=Mo4+]2-; реакция этой промежуточной частицы с Н2О и приводит к образованию гидразина (реакция открыта А. Е. Шиловым с сотрудниками). Лишь для небольшого числа реакций переноса электронов, катализируемых комплексами металлов, характерен происходящий без образования интермедиатов внешнесферный перенос электрона.
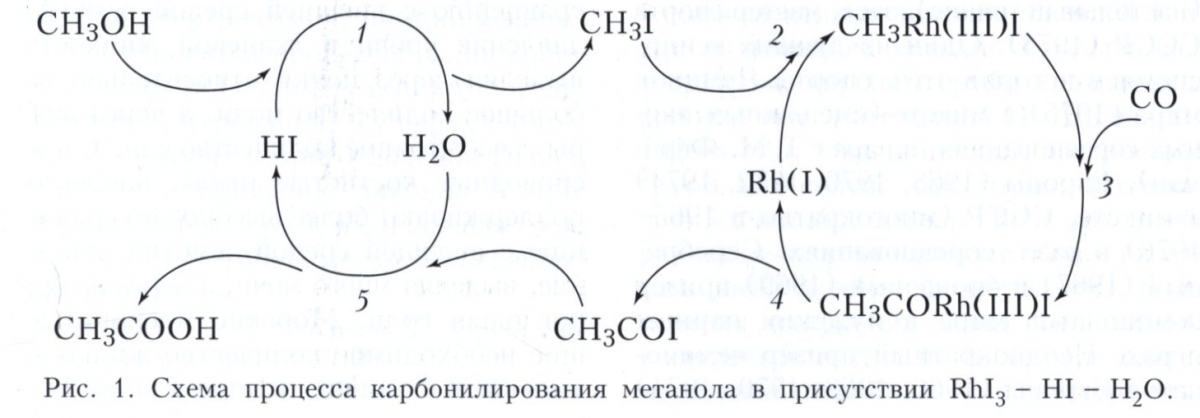
Наиболее распространённый тип металлокомплексного гомогенного катализа - катализ реакций органических соединений с образованием металлоорганических интермедиатов со связями металл-углерод, так называемый металлоорганический катализ. Характерные стадии металлоорганического катализа можно проиллюстрировать на примере двух процессов. Первый - промышленное получение уксусной кислоты карбонилированием метанола в каталитической системе RhI3 - HI - Н2O. Соль Rh(III) является прекурсором активного катализатора - комплекса Rh(I), образующегося по реакции RhI3 + 3СО + Н2O — Rh(CO)2I-2 + СO2 + HI + Н+. Механизм процесса можно изобразить циклической последовательностью стадий (рис. 1). Стадия 1 – замещение на галоген гидроксильной группы, стадия 2 - окислительное присоединение СН3I к Rh(I), стадия 3 - внедрение СО по связи СН3-Rh, стадия 4 - восстановительное элиминирование ацилиодида CH3COI, стадия 5 - нуклеофильное замещение I- в ацилиодиде водой. В этом процессе, кроме комплекса Rh(I), участвует протонный кислотный катализатор HI в двух каталитических циклах. Такие системы называют полифункциональными каталитическими системами.
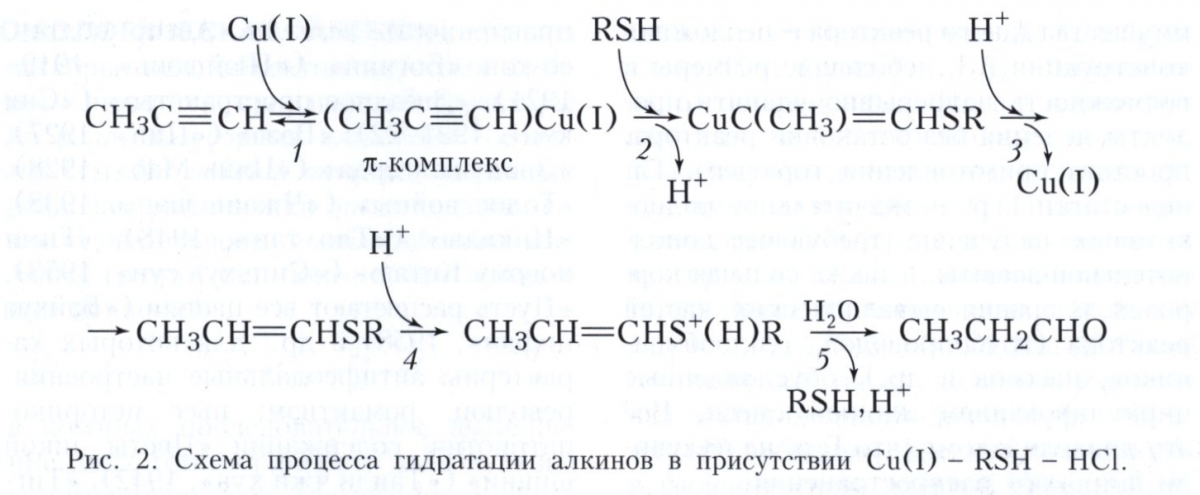
Второй пример - гидратация алкинов с участием трёх катализаторов: комплексов Cu(I) (металлокомплексный катализ), тиола RSH (нуклеофильный катализ) и HCI (протонный кислотный катализ), протекающая против правила Марковникова (рис. 2). Стадия 1 - образование π-комплекса, стадия 2 - нуклеофильное присоединение RSH к π-комплексу, стадия 3 - электрофильное замещение Cu(I) протоном, стадия 4 - электрофильное присоединение Н+ (протонирование тиопропенилового эфира), стадия 5 - нуклеофильное замещение тиола водой.
В металлокомплексном катализе выделяют асимметрический катализ с использованием хиральных металлокомплексных катализаторов, позволяющих проводить реакции стереоселективно (смотри в статье Асимметрический синтез). Например, в промышленности на комплексах Rh(I) с хиральными фосфиновыми лигандами получают дигидроксифенилаланин (препарат для лечения болезни Паркинсона).
Важная технологическая проблема металлокомплексного катализа - отделение катализаторов от продуктов и рециклизация катализаторов - решается за счёт иммобилизации комплексов металлов с помощью лигандов на поверхности носителей или в одной из фаз при использовании двухфазных систем (например, органическая фаза и вода, в которой растворён комплекс металла), использования расплавов органических солей (ионных жидкостей), в которых иммобилизован комплекс металла, применения мембран для отделения продуктов ультрафильтрацией, а также использования термоморфных лигандов или растворителей, меняющих в зависимости от температуры фазовое состояние.
Практическое применение. К числу важнейших промышленных гомогенно-каталитических процессов (кроме названных выше) относятся синтезы с участием СО, олигомеризация этилена с кросс-метатезисом терминальных и интернальных алкенов, димеризация этилена и пропилена, гидрирование функционально замещённых алкенов, нитросоединений, эпоксидирование пропилена, окисление алкилароматических соединений и др. Многие металлокомплексные каталитические процессы по активности катализаторов, хемо-, регио- и стереоселективности приближаются к ферментативным. Использование структурных и функциональных моделей ферментов, принципов протекания биохимических процессов позволяет создавать эффективные процессы металлокомплексного катализа (смотри Биомиметические реакции).
Лит.: Шульпин Г. Б. Органические реакции, катализируемые комплексами металлов. М., 1988; Parshall G. W., Ittel S. D. Homogeneous catalysis. 2nd ed. N. Y., 1992; Моисеев И. И. Катализ: Год 2000 // Кинетика и катализ. 2001. Т. 42. № 1; Applied homogeneous catalysis with organometallic compounds / Ed. В. Cornils, W. А. Herrmann. 2nd ed. Weinheim, 2002. Vol. 1-3.
О. Н. Тёмкин.