Гемоглобины
 ГЕМОГЛОБИНЫ (от гемо... и латинский globus - шарик), железосодержащие красные пигменты крови и гемолимфы, обеспечивающие перенос молекулярного кислорода (О2) от органов дыхания к тканям и частично диоксида углерода (СО2) от тканей к органам дыхания; участвуют в поддержании pH крови. Содержатся в эритроцитах крови всех позвоночных (за исключением некоторых антарктических рыб) и отдельных беспозвоночных или растворены в гемолимфе многих беспозвоночных животных.
ГЕМОГЛОБИНЫ (от гемо... и латинский globus - шарик), железосодержащие красные пигменты крови и гемолимфы, обеспечивающие перенос молекулярного кислорода (О2) от органов дыхания к тканям и частично диоксида углерода (СО2) от тканей к органам дыхания; участвуют в поддержании pH крови. Содержатся в эритроцитах крови всех позвоночных (за исключением некоторых антарктических рыб) и отдельных беспозвоночных или растворены в гемолимфе многих беспозвоночных животных.
Гемоглобины - сложные белки (гемопротеины). Их молекулы состоят из белкового компонента - глобина и простетической железопорфириновой группы - гема, который способен без изменения степени окисления входящего в его состав иона Fe2+ легко присоединять и отдавать О2. Связанный с О2 гемоглобин называется оксигемоглобином. Видовая специфичность гемоглобина обусловлена белковым компонентом, который определяет его растворимость, сродство к О2 и молекулярную массу (у позвоночных она колеблется от 61 000 до 72 000, у беспозвоночных достигает 3000000). Присоединение О2 в органах дыхания (оксигенация) зависит от парциального давления (напряжения) О2 и косвенно регулируется СО2 (как правило, он облегчает отдачу О2 тканям, а его выход из крови, наоборот, способствует её насыщению О2). Связывание СО2 гемоглобином (до 15% всего СО2 крови) происходит сразу после высвобождения О2. При взаимодействии с угарным газом (СО), сродство которого к гемоглобину в 300 раз выше, чем у О2, образуется плохо диссоциирующий карбоксигемоглобин, не способный связывать и переносить О2; развивается кислородная недостаточность (именно этим обусловлена токсичность СО).
Реклама
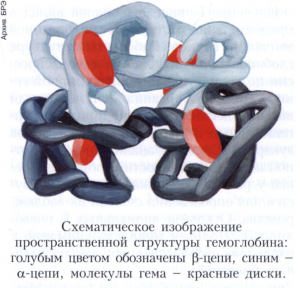
Молекулы гемоглобинов большинства высших позвоночных состоят из нескольких полипептидных цепей, к каждой из которых присоединён гем. Установлены первичная и пространственная структуры многих глобинов из различных источников. Наиболее изучен гемоглобин человека. Его молекула образована четырьмя полипептидными цепями, упакованными в форме тетраэдра. На разных стадиях развития организма человека обнаруживаются гемоглобины, различающиеся составляющими их субъединицами. У взрослых людей до 97% приходится на долю гемоглобина А (от английского adult - взрослый, HbA), глобин которого содержит по 2 идентичные α и β-цепи (α2β2). Около 2% составляет HbA2, у которого вместо β-цепей присутствуют сходные с ними по структуре S-цепи (α2S2). Кроме того, у взрослых людей сохраняется небольшое количество (около 1%) гемоглобина плода (так называемые фетальные гемоглобины, HbF), характерного для внутриутробного периода. Кроме двух α цепей он содержит две γ-цепи (α2γ2) и обладает более высоким сродством к О2, чем HbA и HbA2. На ранних этапах эмбрионального развития присутствуют и другие гемоглобины: типа ζ2ε2, α2ε2 и ζ2γ2. Они обеспечивают снабжение эмбриона кислородом в условиях внутриутробной жизни. HbA начинает преобладать через 2-3 месяца после рождения.
У всех этих гемоглобинов α-глобиновые цепи состоят из 141 аминокислотного остатка и образуют группу α-подобных глобинов.
Остальные глобиновые цепи (состоят из 146 аминокислотных остатков) по ряду свойств отличаются от α-цепей, но сходны между собой и обычно объединяются в группу ß-подобных гемоглобинов. Соответственно этим группам глобинов в геноме человека имеются две группы глобиновых генов, организованных в два кластера. Гены, кодирующие α-подобные цепи гемоглобинов, сцеплены и расположены на хромосоме 16, а кодирующие ß-подобные цепи - на хромосоме 11. Мутации в генах, кодирующих структуру полипептидных цепей гемоглобинов, сопровождаются изменениями в их первичной структуре, связанными с заменами отдельных аминокислотных остатков (у человека известно около 300 форм гемоглобинов). Большая часть подобных замен не влияет на проявление функциональных свойств гемоглобинов, но есть и такие аномальные гемоглобины, которые служат причиной заболеваний - гемоглобинопатий. Например, замена в ß-глобиновой цепи остатка глутаминовой кислоты в положении 6 на остаток валина сопровождается развитием серповидно-клеточной анемии. Различные дефекты структуры глобиновых генов могут уменьшить продукцию гемоглобинов, привести к разбалансировке синтеза α и ß-цепей и к другому заболеванию - талассемии.
Биосинтез гемоглобинов (в костном мозге, в предшественниках эритроцитов - эритробластах, нормобластах, ретикулоцитах) и формирование четвертичной структуры HbA завершается к моменту выхода зрелых эритроцитов в кровяное русло. Гемоглобин синтезируется непрерывно, что обеспечивает его постоянное обновление в организме. В 100 мл крови человека содержится 12-16 г гемоглобина (у женщин меньше, чем у мужчин); снижение этих показателей наряду с уменьшением числа эритроцитов свидетельствует об анемии. Гем гемоглобина после разрушения эритроцитов служит источником образования жёлчных пигментов. У позвоночных образование гемоглобина регулируется гормоном эритропоэтином. В мышцах присутствует структурно родственный гемоглобину белок - миоглобин, который обеспечивает клетки кислородом в условиях его дефицита. У некоторых растений обнаружены аналоги гемоглобина (например, легоглобин, регулирующий кислородный режим азотфиксирующих клубеньковых бактерий).
Изучение гемоглобина внесло большой вклад в представление о структуре, функции и эволюции белков. Работы по структуре глобиновых генов человека и их экспрессии положили началу молекулярной генетике высших организмов и позволили выявить некоторые общие принципы организации и функционирования геномов эукариот. Сравнительный анализ аминокислотной последовательности глобиновых цепей у разных видов животных используется для определения степени их эволюционного родства. Открытие аномальных гемоглобинов позволило Л. Полингу привлечь внимание к изучению наследственных «молекулярных болезней».
Лит.: Human hemoglobins and hemoglobinopathies // Texas Reports on Biology and Medicine. 1981/1982. Vol. 41; Лимборская С. А. Системы глобиновых генов // Итоги науки и техники. Сер. Молекулярная биология. М., 1982. Т. 19; Dickerson R.Е., Geis I. Hemoglobin: structure, function, evolution, and pathology. Menlo Park, 1983; Bunn Н.F., Forget В. G. Hemoglobin: molecular, genetic, and clinical aspects. Phil., 1986.