Изомерия
ИЗОМЕРИЯ (от изо... и греческий μέρος - доля, часть), явление, заключающееся в существовании химических соединений одинаковых по составу с одинаковой молекулярной массой, но различающихся по структуре. Такие соединения называются изомерами. Структурные различия обусловливают различное взаимное влияние атомов в молекулах и предопределяют разные физические и химические свойства изомеров. Изомерия чрезвычайно распространена в органической химии и является одной из основных причин разнообразия и многочисленности органических соединений. В неорганической химии изомерия встречается в основном для комплексных соединений.
Термин «изомерия» ввёл Й. Берцелиус в 1830 году, завершая полемику между Ю. Либихом и Ф. Вёлером по вопросу существования двух резко отличающихся по свойствам веществ, имеющих один и тот же состав AgCNO, - цианата и фульмината серебра и опираясь на результаты исследований винной и виноградной кислот. Сущность изомерии была объяснена позднее на основе теории химического строения.
Выделяют два основных вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры различаются порядком связей атомов в молекуле, то есть химическим строением. Стереоизомеры (пространственные изомеры) при одинаковом порядке связей атомов в молекуле различаются взаимным расположением атомов в пространстве.
Реклама
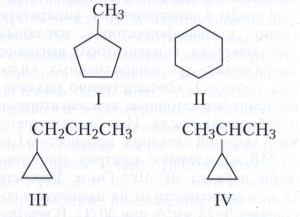
Структурная изомерия подразделяется на изомерию углеродного скелета (скелетную изомерию), изомерию положения (позиционную изомерию), метамерию и другие виды. Изомерия углеродного скелета обусловлена различным порядком связей углеродных атомов, образующих скелет молекулы. Для конкретизации структурных особенностей изомеров скелетная изомерия подразделяется на изомерию углеродной цепи, изомерию цикла и изомерию боковой цепи. Например, изомерия углеродной цепи характерна для алканов начиная с четвёртого члена гомологического ряда С4Н10, который имеет два структурных изомера: н-бутан СН3-СН2-СН2-СН3 и изобутан (2-метилпропан) СН3-СН(СН3)-СН3. Пятый член ряда алканов С5Н12 имеет три изомера: СН3-СН2-СН2-СН2-СН3 - н-пентан, СН3-СН(СН3)-СН2-СН3 - изопентан (2-метилбутан) и неопентан (2,2-диметилпропан) СН3-С(СН3)2-СН3. С удлинением цепи число возможных изомеров быстро возрастает. Так, для алканов состава С10Н22 возможно существование 75 структурных изомеров, для С13Н28 - 802 изомеров, для С20Н42 - более 366 тысяч изомеров. Для алициклических соединений характерны изомерия цикла и изомерия боковой цепи. Например, среди скелетных изомеров (формулы I-IV) метилциклопентан (I), циклогексан (II) и пропилциклопропан (III) являются циклическими изомерами, а пропилциклопропан (III) и изопропилциклопропан (IV) - изомерами боковой цепи. Различия в свойствах скелетных изомеров проявляются в разнице их температур кипения (изомеры с нормальной углеродной цепью кипят при более высокой температуре, чем изомеры с разветвлённой цепью), плотности и др. н-Алканы, например, в отличие от разветвлённых изомеров обладают меньшей детонационной стойкостью (смотри в статье Октановое число), образуют комплексы с мочевиной (клатраты).
Изомерия положения обусловлена различным положением функциональных групп, заместителей или кратных связей. Например, изомерами положения являются 1-пропанол СН3-СН2-СН2ОН и 2-пропанол СН3-СН(ОН)-СН3, 1-бутен СН2=СН-СН2-СН3 и 2-бутен СН3-СН=СН-СН3. Изменение положения функциональной группы может приводить к изменению класса соединения. Например, изомеры положения ацетон СН3-С(О)-СН3 и пропаналь СН3-СН2-СНО относятся соответственно к кетонам и альдегидам. Структурные изомеры с разными функциональными группами сильно различаются по химическим свойствам.
Метамерия обусловлена различным положением гетероатома (О, N, S) в цепи. Например, метамерами являются метилпропиловый эфир СН3 О-СН2-СН2-СН3 и диэтиловый эфир СН3-СН2-О-СН2-СН3, диэтиламин СН3-СН2-NH-СН2-СН3 и СН3-NH-СН2-СН2-СН3 - метилпропиламин.
Часто различия в изомерах определяют несколько структурных признаков. Например, метилизопропилкетон (3-метил-2-бутанон) СН3-С(О)-СН(СН3)2 и валериановый альдегид (пентаналь) СН3-СН2-СН2-СН2-СНО отличаются друг от друга как структурой углеродного скелета, так и положением функциональной группы.
Особым видом структурной изомерии является таутомерия (равновесная динамическая изомерия). В этом случае изомеры, различающиеся функциональными группами, легко переходят друг в друга до достижения равновесия, при котором вещество одновременно содержит молекулы таутомеров в определённом соотношении.
Пространственная изомерия подразделяется на геометрическую (цис,транс и син,анти-изомерию, или Е,Z-изомерию) и оптическую (энантиомерию). Геометрическая изомерия характерна для соединений, содержащих двойные связи или неароматические циклы, являющиеся структурно жёсткими фрагментами молекул. У цис-изомеров два заместителя расположены по одну сторону плоскости двойной связи или цикла, у транс-изомеров - по разные стороны. Например, геометрическими изомерами являются цис-2-бутен (формула V) и транс-2-бутен (VI), цис-1, 2-дихлорциклопропан (VII) и транс-1,2-дихлорциклопропан (VIII).
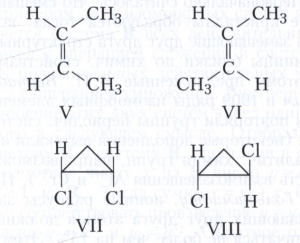
Характерными различиями между циси транс-изомерами являются более низкая температура плавления цис-изомеров, значительно лучшая растворимость в воде и явно выраженный дипольный момент. Транс-изомеры обычно более стабильны. Смотри, например, в статье Малеиновая и фумаровая кислоты.
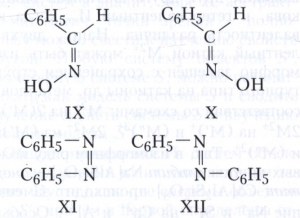
Геометрическую изомерию, наблюдаемую для соединений с двойными связями С=N (оксимы) и N=N (азо-, азоксисоединения), часто называют син,анти-изомерия. Например, геометрическими изомерами являются анти-бензальдоксим (формула IX) и син-бензальдоксим (Х); син-азобензол (XI) и анти-азобензол (XII).
В общем случае используется Ε,Z-номенклатура. У Z-изомеров старшие заместители (имеющие больший атомный номер) расположены по одну сторону двойной связи или цикла, у Е-изомеров - по разные стороны. Например, геометрическими изомерами являются (Z)-1-бром1-иод-2-хлорэтилен (формула XIII) и (Е)-1 -бром-1 -иод-2-хлорэтилен (XIV).
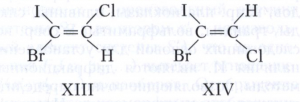
Оптическая изомерия характерна для соединений, молекулы которых имеют элементы хиральности, например асимметрический (хиральный) атом углерода, связанный с четырьмя разными заместителями. Впервые обнаружена Л. Пастером в 1848 на примере винных кислот и объяснена Я. Х. Вант-Гоффом и Ж. А. Лe Белем в 1874 году на основе представлений о тетраэдрической конфигурации углеродных атомов в насыщенных соединениях. Молекулы, содержащие асимметрический атом углерода, могут быть представлены в виде двух оптических изомеров, которые не могут быть совмещены в пространстве (т. е. относятся друг к другу как предмет к своему зеркальному изображению). Такие зеркальные изомеры, отличающиеся лишь противоположным расположением одних и тех же заместителей у хирального центра, называются энантиомерами (от греческого έναντίος - противоположный и μέρος - часть). Например, энантиомеры молочной кислоты (XV и XVI) можно представить в трёхмерном изображении или в виде формул Фишера (смотри в статье Химическая номенклатура).
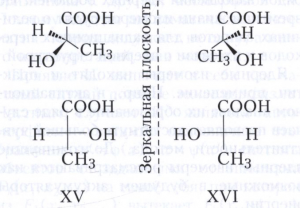
Энантиомеры имеют различную биологическую активность; для них характерна также оптическая активность - способность воздействовать на плоскополяризованный свет (вращать плоскость поляризации). Энантиомеры вращают плоскость поляризации на один и тот же угол, но в противоположном направлении, поэтому их называют оптическими антиподами.
Длительное время конфигурацию энантиомеров определяли относительно конфигурации известного стандарта, которым служили энантиомеры глицеринового альдегида (D, L-стерические ряды). Более универсальной является R, S-номенклатура (предложена Р. Каном, К. Ингольдом и В. Прелогом), устанавливающая абсолютную конфигурацию пространственных изомеров. В соответствии с правилами R, S-номенклатуры энантиомеры молочной кислоты (XV, XVI) являются соответственно (R)-молочной и (S)-молочной кислотами. Правил перевода D, L-номенклатуры в R, S-систему не существует, так как в этих номенклатурах используются разные принципы. Не установлено также связи между абсолютной конфигурацией и параметрами оптического вращения.
Для соединений, имеющих n хиральных центров в молекуле, количество возможных стереоизомеров составляет 2". Однако при n ≥2 существуют стереоизомеры, которые отличаются друг от друга частью имеющихся в них элементов хиральности. Такие стереоизомеры, не являющиеся энантиомерами, называют диастереомерами (от греческого δια... – через, между, стерео... и μέρος - часть). Например, для хлоряблочной кислоты, имеющей два асимметрических атома углерода, существуют четыре стереоизомера (формулы XVII-XX), среди которых пары XVII и XVIII, а также XIX и XX являются энантиомерами, остальные пары (XVII и XIX, XVII и XX, XVIII и XIX, XVIII и XX) - диастереомеры.
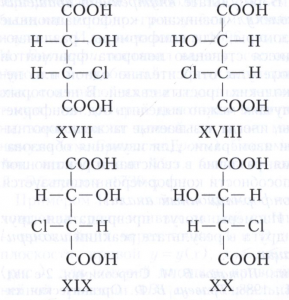
При появлении дополнительных элементов симметрии (плоскости, оси или центра симметрии) общее число стереоизомеров, а также количество оптически активных форм может уменьшаться. Например, винные кислоты имеют три стереоизомера, из них два оптически активные: D-винная кислота, или (2R,3R)-винная кислота (формула XXI), и L-винная кислота, или (2S,3S)-винная кислота (XXII), являющиеся энантиомерами. Их диастереомер - мезовинная кислота, или (2R,3S)-винная кислота (формула XXIII, или идентичная конфигурация XXIV), вследствие наличия плоскости симметрии (обозначена пунктиром) оптически недеятельна - является так называемым внутримолекулярным рацематом.
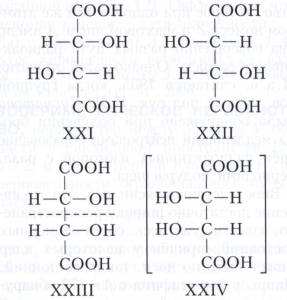
Процесс взаимопревращения энантиомеров называется рацемизацией. Смесь равных количеств оптических антиподов - рацемическая смесь, или рацемат, не обладает оптической активностью. Стереоизомерии уделяется большое внимание при изучении природных соединений и синтезе биологически активных веществ. Веществам природного происхождения, содержащим элементы хиральности, присуща определённая стереоконфигурация, а также оптическая активность. При формировании хирального центра в условиях химического синтеза (за исключением асимметрического синтеза) образуется рацемат; для выделения энантиомеров требуется применение сложных методов разделения рацемата на оптически активные компоненты.
В результате внутреннего вращения молекул возникают конформационные изомеры, или конформеры, различающиеся степенью поворота фрагментов молекулы относительно одной или нескольких простых связей. В некоторых случаях можно выделить отдельные конформеры, иногда называемые также поворотными изомерами. Для изучения образования, различия в свойствах и реакционной способности конформеров используется конформационный анализ.
Изомеры могут превращаться друг в друга в результате реакций изомеризации.
Лит.: Потапов В. М. Стереохимия. 2-е изд. М., 1988; Травень В. Ф. Органическая химия. М., 2004. Т. 1.
В. В. Москва.