Вода
ВОДА (оксид водорода), простейшее устойчивое химическое соединение водорода с кислородом, Н2О; при нормальных условиях - жидкость без запаха, вкуса и цвета. Одно из самых распространённых на Земле соединений, играющее исключительно важную роль в разнообразных процессах живой и неживой природы Земли. Истинный состав воды как сложного вещества был впервые установлен А. Лавуазье в 1783 году.
Греческое название ?δωρ (смотри Гидро...), латинский aqua - аква.
Распространённость в природе. Вода образует гидросферу, входит в связанном виде в состав различных минералов и горных пород, является обязательным компонентом всех живых организмов, присутствует в почве и атмосфере. Молекулы воды обнаружены в межзвёздном пространстве; вода входит в состав комет, большинства планет Солнечной системы, спутников.
Количество воды на поверхности Земли оценивается в 1,39?1021 кг, большая часть содержится в морях и океанах (1,34?1021 кг); смотри также таблицу в статье Воды суши. В глубинных слоях Земли воды значительно больше, чем на поверхности, - (1,1-1,3) ?1021 кг в литосфере, (1,3-1,5) ?1022 кг в мантии Земли. Количество доступных пресных вод составляет 2?1017 кг. В атмосфере находится около 1,3?1016 кг. На Земле существует постоянный кругооборот воды (смотри Влагооборот, Водный баланс).
Реклама
Природная вода всегда содержит растворённые соли, газы и органические вещества, а также коллоидные частицы и микроорганизмы. Состав примесей зависит от происхождения воды. По минерализации различают следующие виды воды: атмосферные осадки (10-20 мг/кг), ультрапресные (до 200 мг/кг), пресные (200- 500 мг/кг), слабоминерализованные (0,5-1,0 г/кг), солоноватые (1-3 г/кг), солёные (3-10 г/кг), с повышенной солёностью (10-35 г/кг), переходные к рассолам (35-50 г/кг), рассолы (более 50 мг/кг); максимальные концентрации солей содержат вода соляных озёр (до 300 г/кг) и глубокозалегающие подземные воды (до 600 г/кг). В пресных водах преобладают ионы НСО-3, Са2+, Mg2+, Сl-, Na+, SO2-4, К+ (смотри также Минеральные воды, Жёсткость воды). К микрокомпонентам природной воды относятся В, Li, Rb, Cu, Zn, Al, Be, W, U, Br, I и др. Из растворённых газов в природных водах присутствуют N2, О2, СО2, благородные газы, редко Н2S и углеводороды. Концентрация органических веществ в водах рек около 20 мг/кг, в водах океана - около 4 мг/кг, причём их состав чрезвычайно разнообразен. Смотри также Гидрохимия.
Изотопный состав. Существует 9 разновидностей молекул воды, включающих только стабильные изотопы. Их содержание в природной воде в среднем составляет (мол. %): 1Н216О - 99,73; 1Н218O - 0,2; 1Н217O - 0,04; 1Η2Η16O - 0,03; остальные присутствуют в ничтожных количествах. Природная вода содержит также радиоактивный тритий. По физическим свойствам изотопные разновидности воды несколько различаются; тяжёлая вода существенно отличается по свойствам от природной.
Строение молекулы и физические свойства. Атомы Н и О в молекуле воды расположены в вершинах равнобедренного треугольника с длиной связи О-Н 0,0957 нм; валентный угол Н-О-Н 104,5°. Электронная плотность молекулы воды распределена таким образом, что возникают 4 полюса зарядов, расположенные в вершинах искажённого тетраэдра: два положительных на атомах Н и два отрицательных на неподелённых электронных парах атома О. Дипольный момент 6,17-10-30 Кл м, энергия ионизации 12,6 эВ, сродство к протону 7,1 эв.
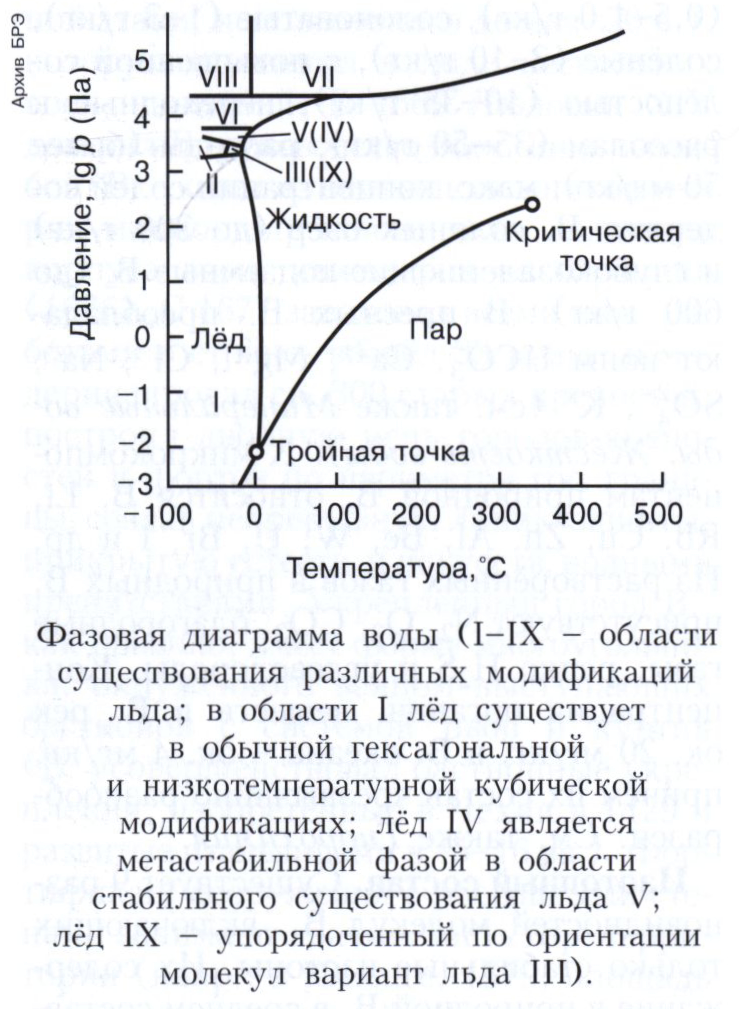 Вода может существовать в твёрдом (лёд), жидком и газообразном состояниях. Дипольные молекулы воды взаимодействуют друг с другом и с полярными молекулами других веществ (атомы водорода могут образовывать водородные связи с атомами О, N, F, Cl, S и др.). Каждая молекула воды способна образовывать 4 водородные связи: две - как донор протонов, две - как акцептор. Средняя длина таких связей в кристаллических модификациях льда (известно 10 кристаллических модификаций льда) и кристаллогидратах около 0,28 нм. Угол О—Н???О стремится к 180°. В обычных условиях лёд существует в гексагональной модификации; угол Н-О-Н близок к тетраэдрическому (109,5°), что обусловливает рыхлость структуры льда. При увеличении внешнего давления лёд переходит в модификации с большей плотностью (рис.); максимальная плотность льда 1660 кг/м3.
Вода может существовать в твёрдом (лёд), жидком и газообразном состояниях. Дипольные молекулы воды взаимодействуют друг с другом и с полярными молекулами других веществ (атомы водорода могут образовывать водородные связи с атомами О, N, F, Cl, S и др.). Каждая молекула воды способна образовывать 4 водородные связи: две - как донор протонов, две - как акцептор. Средняя длина таких связей в кристаллических модификациях льда (известно 10 кристаллических модификаций льда) и кристаллогидратах около 0,28 нм. Угол О—Н???О стремится к 180°. В обычных условиях лёд существует в гексагональной модификации; угол Н-О-Н близок к тетраэдрическому (109,5°), что обусловливает рыхлость структуры льда. При увеличении внешнего давления лёд переходит в модификации с большей плотностью (рис.); максимальная плотность льда 1660 кг/м3.
Трёхмерная сетка водородных связей, построенная из тетраэдров, сохраняется и в жидкой воде Установлено объединение молекул воды в ассоциаты и даже в обширные кластеры (130 молекул Н2О при 0 °С, 90 - при 20 °С, 60 - при 72 °С, время жизни 10-11-10-10 с).
Некоторые параметры, характеризующие основные физические свойства воды в различных агрегатных состояниях (при давлении 1013,25 гПа), приведены далее:

Строение молекулы воды и наличие водородных связей обусловливают аномалию физических свойств. Так, плотность воды имеет максимум (1000 кг/м3) при 3,98 °С и при замерзании резко падает (увеличение объёма на 9%). Увеличение плотности при плавлении объясняется вхождением части несвязанных молекул воды в пустоты трёхмерной сетки. С другой стороны, усиливающееся при нагревании тепловое движение молекул обусловливает уменьшение плотности. Наличие этих двух противоположных тенденций объясняет своеобразную - возникновение максимума - зависимость объёма воды от температуры. Наличие пустот в структуре льда является также причиной способности воды к значительному переохлаждению (вплоть до -30 °С). Кроме того, высокая прочность водородных связей (около 21 кДж/моль) объясняет высокие значения температур кипения и плавления, удельных теплот плавления и кипения, диэлектрической проницаемости и др. Аномалии наблюдаются также в температурной зависимости удельной теплоёмкости (минимум при 35 °С), уменьшении вязкости с ростом давления, малой сжимаемости и её уменьшении с ростом температуры. Тройная точка воды (равновесие жидкая вода - лёд - пар) соответствует температуре 0,01 °С и давлению 6,1 гПа. О физических свойствах воды в твёрдом состоянии смотри также в статье Лёд.
Вода как растворитель. Высокие диэлектрическая проницаемость и дипольный момент воды определяют её хорошую растворяющую способность по отношению к полярным и ионогенным веществам. Обычно растворимость возрастает с увеличением температуры. Растворимость в воде малополярных веществ (в том числе газов) сравнительно мала. С ростом давления и при понижении температуры растворимость газов возрастает. Многие вещества реагируют с водой при растворении. Между растворёнными в воде ионами, атомами, молекулами, не вступающими с ней в химические реакции, и молекулами воды существуют ион-дипольные и межмолекулярные взаимодействия (смотри Гидратация).
Вследствие высокой растворяющей способности воды получить её в чистом виде трудно. Для научных исследований, в медицине и пр. применяют дистиллированную воду, абсолютно чистую воду синтезируют из Н2 и О2. Для бытовых и технических целей воду очищают (смотри Водоподготовка).
Химические свойства. Вода - слабый электролит, диссоциирующий по уравнению: Н2O→← Н++OH- (смотри Электролитическая диссоциация). Протон мгновенно гидратируется с образованием ионов гидроксония Н3O+ (энтальпия образования -1121,3 кДж/моль). Степень диссоциации воды возрастает при повышении температуры. Диссоциация воды - причина гидролиза солей слабых кислот и оснований. Концентрация ионов Н+ - важная характеристика водных растворов (смотри Водородный показатель).
Образование воды из элементов при низких температурах происходит крайне медленно; скорость реакции резко возрастает при повышении температуры (при 550 °С - со взрывом). Под действием УФ-излучения происходит фотодиссоциация воды. Ионизирующее излучение вызывает радиолиз воды с образованием Н2, Н2O2 и свободных радикалов (Н?, ОН?, HO?2).
Вода окисляется атомарным кислородом до Н2О2. При взаимодействии воды с F2 образуются HF и другие соединения. С остальными галогенами при низких температурах вода образует смеси кислот (например, НСl и HClO). При пропускании паров воды через раскалённый уголь Н2О разлагается на водяной газ (СО и Н2). При повышенной температуре в присутствии катализатора реагирует с СО и углеводородами с образованием Н2 (используют для промышленного получения Н2; смотри Водородная энергетика). Вода взаимодействует с наиболее активными металлами с образованием Н2 и соответствующего гидроксида. При взаимодействии воды со многими оксидами образуются кислоты или основания. С солями образует кристаллогидраты, со многими газами при низких температурах (инертные газы, углеводороды) - соединения включения, газовые гидраты. Присоединение воды к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов, альдегидов и кетонов.
Значение. Без воды невозможно существование живых организмов. Воде принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании среды, климата и погоды. Благодаря высоким значениям удельной теплоёмкости, теплоты плавления и теплоты испарения, вода оказывает стабилизирующее воздействие на температуру поверхности Земли. Аномальная зависимость плотности от температуры и низкая плотность льда препятствуют промерзанию водоёмов, что обусловливает существование в них жизни. Некоторые из физических свойств воды положены в основу определения единиц измерения фундаментальных физических констант (массы, плотности, температуры, теплоты и удельной теплоёмкости). Вода - обязательный компонент многих технологических процессов (в том числе рабочее тело в паровых машинах, растворитель, хладагент, теплоноситель), химический реагент в промышленном производстве ряда кислот, щелочей, кислорода, водорода и пр., компонент лекарственных средств, продуктов питания и пр.; морская и озёрная вода, а также рассолы - сырьевой источник. Смотри также Водные ресурсы.
Лит.: Water, а comprehensive treatise / Ed. F. Franks. N.Y., 1972-1982. Vol. 1-7; Pивкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара: Справочник. 2-е изд. М., 1984; Антонченко В. Я. Физика воды. К., 1986; Зацепина Г. Н. Физические свойства и структура воды. 3-е изд. М., 1998; Яшкичев В. И. Вода, движение молекул, структура, межфазные процессы и отклик на внешние воздействия. М., 1998; Frost Н. Water as а liquid. Mankato, 2000; idem. Water as а solid. Mankato, 2000; idem. Water as а gas. Mankato, 2000; Артемьева С. Вода: (Свойства, ресурсы, использование). Рекомендательный указатель литературы. М., 1981.
А. А. Елисеев, Ю. Д. Третьяков.
Биологическая роль воды обусловлена её уникальной химической структурой. В водной среде возникла жизнь. Для водных и околоводных организмов вода служит средой обитания. Недостаток воды вызывает нарушение жизнедеятельности всех организмов, а её длительное отсутствие могут переносить лишь покоящиеся формы жизни (споры, семена растений). В большинстве случаев вода является неотъемлемым компонентом живых организмов; она находится внутри клеток и служит основой внеклеточных жидкостей (например, гемолимфа и кровь у животных, флоэмный и ксилемный потоки у растений). Функции воды многообразны - она служит растворителем для различных соединений, средой для реакций обмена веществ, определяет объём клеток и внеклеточных жидкостей, обеспечивает транспорт веществ в организме, участвует в терморегуляции. Содержание воды в разных организмах различается: например, у водорослей на долю воды приходится 90-98%, в листьях наземных растений - 75-86, в семенах злаков - 12-14, у мхов и лишайников - 5-7, у кишечнополостных - 95-98, у насекомых - 45-65, у млекопитающих - 60-70%; неодинаково оно и в различных органах и тканях: например, в корковом веществе почки крыс - 74,6% воды, в мышце - 75,1, в белом веществе мозга - 76,4, в сером - 79,8%.
В организм вода поступает из внешней среды; она появляется там также в ходе метаболизма (например, у животных при окислении 100 г жиров образуется 107 мл воды, а при окислении 100 г углеводов - 55 мл). Транспорт молекул воды через биологические мембраны происходит по специальным каналам - аквапоринам. Всасывание воды через мембраны зависит от их осмотической проницаемости и определяется градиентом концентрации осмотически активных веществ по обеим сторонам мембраны. В организме образование воды, практически не содержащей растворённых веществ, происходит в некоторых отделах канальцев выделительных органов, протоках ряда желёз с внешней секрецией и сократительных вакуолях. Образование и выделение гипертонических жидкостей (секреты солевых желёз, моча) способствуют стабилизации водного баланса и осмоляльности (общего количества растворённых веществ) жидкостей внутренней среды организма. У живых существ сформировались системы стабилизации водного обмена при обитании в средах, контрастных по солевому составу и доступности воды (пресные водоёмы, моря, пустыни), это обеспечивается системами осморегуляции и волюморегуляции (поддержания постоянства объёма жидкости тела).
В организме человека вода находится в различных жидкостных фазах: внутриклеточной (около 55% всей воды тела) и внеклеточной (45%) - в сосудах (кровь, лимфа) и в межклеточном пространстве. Содержание воды уменьшается с возрастом: у новорождённого ребёнка 79% от массы тела, в возрасте 3-6 месяцев - 70%, у 6-12-месячных - около 60%. У мужчин содержание воды выше, чем у женщин: в возрасте 16-39 лет около 60% от массы тела, в 40-59 лет - 55%, в 60 лет и старше - около 51% и меньше, у женщин соответственно 50, 46,7, 45,5%. Смотри также Водно-солевой обмен и Водный режим растений.
Ю. В. Наточин.